
免疫检查点抑制剂在非小细胞肺癌中的应用
介绍
肺癌是最常见和最致命的恶性肿瘤之一,每年导致全球169万人死亡[1]。非小细胞肺癌(NSCLC)占这些病例的大多数(80%~85%)。尽管在过去的30年里,美国NSCLC的5年的总生存率略有提高,仅仅从12%升到18%,最近的治疗进展可能会改善这一悲观趋势[2]。靶向治疗,包括血管内皮生长因子(VEGF)抑制剂,如贝伐珠单抗和酪氨酸激酶抑制剂,是NSCLC的第一个重要进展。然而,这些治疗方法的范围受到组织学(即贝发珠单抗仅用于非鳞状NSCLC)或肿瘤突变状态(EGFR,ALK和BRAF)的限制。相比之下,免疫治疗在所有非小细胞组织学和多种治疗方法中都得到了广泛的应用。免疫治疗指利用病人的先天免疫系统来识别和消除恶性肿瘤的抗癌疗法,在NSCLC中免疫治疗的成功集中在免疫检查点抑制剂的发展。
免疫检查点抑制剂构成了一类新的抗肿瘤药物,并已经显示具有良好的临床疗效。这些免疫检查抑制剂包括程序性死亡-1(PD-1)抑制剂,(如纳武利尤单抗和派姆单抗)和程序性死亡配体(PD-L1)抑制剂(如阿替利珠单抗和度伐利尤单抗),以及细胞毒性T淋巴细胞相关抗原4(CTLA-4)抑制剂(如伊匹单抗和曲美木单抗)。本文将探讨免疫检查点抑制剂在NSCLC中的作用机制和临床应用。
免疫检查点抑制剂作用机制
免疫检查点抑制剂的作用机制涉及肿瘤细胞与自然免疫系统之间的相互作用。突变是指正常细胞转化为肿瘤细胞会产生新抗原,免疫系统将识别癌细胞为异常[3]。PD-1是一种表达在活化的T细胞上的蛋白标记,PD-L1和PD-L2通常在肿瘤细胞上表达,免疫细胞PD-1受体和肿瘤细胞PD-L1配体抑制了T细胞活化,本质上是保护肿瘤细胞免受免疫监视。尽管PD-L1表达在正常细胞中起调节自体免疫并防止T细胞异常活化攻击正常细胞,肿瘤细胞可能过度表达PD-L1逃避免疫监视。由于这种过度表达,T细胞PD-1和肿瘤细胞PD-L1相互作用已经被认为是一种治疗靶点。PD-1/PD-L1检查点抑制剂阻断了这种相互作用,从而恢复了T细胞介导的抗肿瘤免疫应答[4]。
免疫检查点抑制剂的靶点是PD-1和PD-L1,基于上述表达的差异,PD-1和PD-L1抑制剂之间的活性有细微的差异,据推测,PD-1与心脏、肺和肾实质细胞上表达的PD-L2提供了阻止自身免疫的负信号[5]。因此,PD-1抑制剂可能通过阻断这种相互作用而无意中导致自身免疫毒性的增强,而PD-L1抑制剂可能通过保持PD-1/PD-L2通路的完整来逃避其中一些免疫介导效应。临床上,自身免疫毒性的差异尚未完全明确,这些药物在相似的治疗模式中使用。
免疫组化检测的PD-L1表达是临床试验中抗PD-1/PD-L1治疗最常用的生物标志物。在早期临床试验中,对PD-L1的表达进行了评估,但通常研究入组不要求。此外,应用了不同的单抗:纳武利尤单抗试验用克隆28-8试剂盒检测肿瘤PD-L1的表达[6-8],帕博利珠单抗试验通过免疫组化22C3试剂盒评估了PD-L1的表达[9],阿替利珠单抗试验则应用SP142试剂盒检测肿瘤细胞和肿瘤浸润的免疫细胞上PD-L1的表达[10]。就肿瘤细胞PD-L1表达目前有几种被批准的检测和治疗方法。然而,也存在局限性,组织质量、肿瘤异质性和表达活性会影响检测结果[11]。其他潜在生物学标记,例如:肿瘤突变负荷,正在在其他临床试验中进行评估,希望找出从免疫治疗中临床获益的特定人群[8]。
目前有四种PD-1/PD-L1抑制剂可用于临床,两种PD-1抑制剂是纳武单抗和派姆单抗,它们都是人源化免疫球蛋白G4抗体。两种PD-L1抑制剂,如阿替利珠单抗和度伐利尤单抗,是人源化的免疫球蛋白G1单克隆抗体。
CTLA-4是一种自然存在的T细胞调节蛋白,表达在T细胞上,并通过与抗原提呈细胞上的CD80(B7-1)或CD86(B7-2)结合来下调免疫反应,抑制CTLA-4可增加T细胞活化,促进T细胞增殖,并降低调节性T细胞介导的免疫抑制[12-14],CTLA-4抑制剂是第一个可用的免疫检查点抑制剂,并已成功用于黑色素瘤的治疗,伊匹单抗在美国被批准用于黑色素瘤,是一种人免疫球蛋白G1单克隆抗体,靶点是CTLA-4。特雷利姆单抗是在研以CTLA-4为靶点的选择性人免疫球蛋白G2单克隆抗体4[13],这些药物在NSCLC的治疗上还没有上市,但在临床试验中与PD-1/PD-L1抑制剂联合使用。
晚期NSCLC的免疫治疗
免疫检查点抑制剂已经有未经治疗过(一线)和以前治疗过的(二线和以后)转移性NSCLC患者的适应证。免疫治疗也被用于局部晚期NSCLC放化疗后的巩固治疗。目前,抗PD-1/PD-L1仅被批准作为单一药物或联合细胞毒性化疗用来治疗NSCLC(见表1)。正在进行的研究,包括抗PD-1/PD-L1和抗CTLA-4药物的联合免疫治疗。
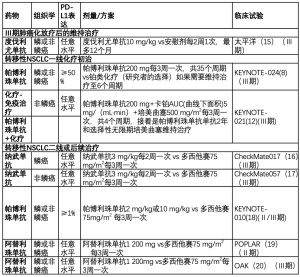
Full table
转移性NSCLC的一线免疫治疗
单药免疫治疗
过去,化疗一直是转移性NSCLC默认的一线治疗方案。然而,最近的试验已经确定了免疫检查点抑制剂在一线治疗中的作用。与二线治疗相反,单药免疫检查点抑制剂证明在选择的特定患者中是有效的。两个不同结果的类似试验已经证实单药免疫治疗的作用,分别是CheckMate 026[21]和KEYNOTE-024[22]。
Ⅲ期临床试验CheckMate 026,比较了初治Ⅳ期或复发的非小细胞肺癌患者中纳武单抗(3 mg/kg每2周一次)和研究者选择含铂双药化疗(如果有必要,最多可达到6个周期的维持治疗)。该实验包括非鳞和鳞癌并且需要PD-L1表达≥1%。大多数患者是非鳞癌(76%),并且多数患者PD-L1表达≥5%(77%>5%;40%≥50%)。在423名PD-L1表达≥5%的患者中,与化疗相比纳武单抗没有呈现出更长的无进展生存期(PFS)[4.2 vs 5.9个月;风险比(HR):1.15;95%置信区间CI,0.91-1.45;P=0.25]。纳武单抗组的应答率是26%,而化疗组的应答率是33%,纳武单抗组和化疗组总生存期中位数是相似的(分别是14.4 vs 13.2m;HR:1.02;95%CI,0.80-1.30),3或4级治疗相关的不良反应(AEs)纳武单抗组(18%)比化疗组(51%)低。基于这些阴性结果,纳武单抗目前未被批准作为初治患者的单药治疗。
相比之下,Ⅲ期临床试验(KEYNOTE-024)对比了初治进展期NSCLC且PD-L1≥50%的305例患者使用帕博利珠单抗(200 mg 每3周一次)和含铂类化疗,证实了帕博利珠单抗在一线治疗中的疗效。早期试验证实有效(显效率、无进展生存期和总生存期)是基于选择了PD-L1高表达的患者,因此,帕博利珠单抗一线用于PD-L1表达≥50%的患者[23,24]。与纳武单抗试验相似的是,大多是患者是非鳞癌(81%~82%)。在KEYNOTE-024中,与含铂化疗相比,帕博利珠单抗组有更长的中位PFS(10.3个月与6.0个月;HR,0.50;95%CI,0.37-0.68;P<0.001)和OS(HR,0.60;95%CI,0.41-0.89;P=0.005);与化疗相比,帕博利珠单抗组的应答率也相对较高(44.7% vs 27.8%);而且帕博利珠单抗组的3级或更高级别的治疗相关不良反应(irAE)的发生率要低(26.6% vs 53.3%)[22]。基于这些结果,帕博利珠单抗已被批准用于单药治疗初治的非小细胞肺癌且肿瘤高表达PD-L1表达≥50%患者。
阿替利珠单抗在一线治疗中也已经评价,尽管它未被批准用于该适应证。BIRCH是一项Ⅱ期试验,研究了阿替利珠单抗(1 200mg Ⅳ每3周一次)用于晚期或复发的NSCLC且PD-L1表达≥5%的患者。这项研究包括三个队列,包括一线治疗患者142例,其中主要是非鳞状癌(77%)和一小部分EGFR突变和ALK阳性患者(11%和4%,总共16名患者)。对于一线治疗反应率(22%;95%CI,15-29),中位PFS(5.4个月;95%CI,3.0-6.9)和中位OS(20.1个月;95%CI,20.1至不可估计),与纳武单抗试验观察到的结果相似。EGFR突变和非突变的患者反应率也相似[16]。
化学-免疫治疗
作为单药治疗的后续治疗,化疗联合免疫已被评价。化疗联合帕博利珠单抗已在美国获批;化疗和纳武单抗的组合目前在研究阶段,未被批准常规用于临床。
化疗联合免疫的获批是基于KEYNOTE-021试验,这是一项Ⅱ期研究,评价了未接受化疗的ⅢB期或Ⅳ期的非鳞非小细胞肺癌患者在使用卡铂和培美曲塞时是否联合帕博利珠单抗,与单用帕博利珠单抗试验对比,入组患者不需要检测PD-L1表达水平。在联合治疗组中,35%的PD-L1表达<1%和33%有PD-L1表达>50%(与只有化疗组相似)。化免联合与单一化疗相比中位PFS显著改善,帕博利珠单抗联合化疗13个月(95%CI,8.3至未达到),单一化疗的中位PFS为8.9个月(95%CI,4.4-10.3)。联合治疗组的客观反应率为55%(33/60)而单一化疗组为29%(18/63)。3级或更高级别的治疗相关不良事件(TrAEs)在两组中是相似的(化免联合组为39%,单一化疗组为25%)[9]。基于这个数据,化疗与帕博利珠单抗联合治疗在美国被批准。正在进行的Ⅲ期研究证实了这些发现,包括KEYNOTE-189(在非鳞非小细胞肺癌患者中铂类和培美曲塞联合或不联合帕博利珠单抗)[25]和KEYNOTE-407(研究了在鳞状非小细胞肺癌中使用卡铂和紫杉醇或白蛋白结合型紫杉醇是否联合帕博利珠单抗)[18]。
其他免疫检查点抑制剂和化疗联合也进行了研究。一个随机的Ⅲ期试验评价初治鳞状细胞肺癌中卡铂和紫杉醇与伊匹单抗联合组没有呈现出生存获益(OS,13.4个月vs12.4个月;P=0.25),并且化疗和免疫联合使用增加了毒性[19]。Ⅰ期试验(CheckMate 012)包括几个组合的治疗序列:在鳞组中纳武单抗联合吉西他滨和顺铂,在非癌联合培美曲塞和顺铂,或联合紫杉醇和卡铂不考虑组织类型。所有患者均接受4个周期的治疗,随后纳武单抗维持治疗直至疾病进展或不能耐受的毒性。结果证明客观反应率(ORR)为46%,中位无进展生存期(PFS)为6个月(95%CI,4.8-8.3),和中位总生存期为19.2个月(95% CI,14.1-23.8)。不管PD-L1的表达水平如何,ORR和OS是相似的[20]。CheckMate 012也评估了一线联合免疫治疗:纳武单抗和伊匹单抗的联合,评估了两种给药方案——纳武单抗(3mg/kg 每2周1次)与伊匹单抗(1mg/kg 每6周1次或每12周1次),给药频率越低反应率和PFS越好(47% vs 38%反应率和8.1 vs 3.9个月的PFS每12周1次 vs 每6周1次)[15]。
CheckMate227是一项后续Ⅲ期试验,入组2 500例初治的任何组织类型的IV期或复发的非小细胞肺癌患者对比了纳武单抗单药,纳武单抗联合伊匹单抗、纳武单抗联合铂类双药化疗或含铂类双药化疗。根据PD-L1的表达进行分层,1a组部分纳入了PD-L1表达阳性的患者,并随机分配至纳武单抗联合伊匹单抗组、纳武单抗单药治疗组或化疗组。1b组纳入了PD-L1表达阴性的患者,随机分到纳武单抗联合伊匹单抗组、纳武单抗联合化疗组或单纯化疗组。除了PD-L1的表达,这个试验也评估了肿瘤突变负荷,是一个潜在的生物标志物,但这些结果尚不可用[17]。之前已将肿瘤突变负荷(TMB)认为是潜在的反应预测因子[8]。
转移性NSCLC的二线免疫治疗
对于一线没有接受免疫治疗的患者,有多种竞争性选择和可用的药物包括纳武单抗、帕博利珠单抗和阿替利珠单抗。其他几种PD-1/PD-L1抑制剂目前已被评估,但还没有用在转移性NSCLC(包括阿维单抗和度伐单抗)。这部分关注在这种治疗模式下,纳武单抗、帕博利珠单抗和阿替利珠单抗的治疗有效性。
有两个独立的Ⅲ期试验评价纳武单抗的二线治疗作用:评估鳞状非小细胞肺癌的CheckMate 017研究[7]和评估非鳞状细胞非小细胞肺癌的CheckMate 057研究。两项试验都比较了使用纳武单抗(3 mg/kg 每2周1次)和多西紫杉醇(75 mg/m2 每3周1次)治疗铂类方案治疗期间或之后疾病进展的ⅢB/Ⅳ期NSCLC患者。在鳞癌试验中,中位OS(9.2个月vs6个月),1年生存率(42%vs24%;HR,0.59;P<0.001),反应率(20%vs 9%;P=0.008)和中位 PFS(3.5个月与2.8个月;HR,0.62;95% CI,0.47–0.81;P<0.001),在纳武单抗组更好[7]。非鳞癌试验取得了类似纳武单抗组疗效更好的阳性结果:中位OS(12.2个月和9.4个月;HR,0.73; 95% CI,0.59–0.89; P=0.002) 和 反应率(19%vs 12%;P=0.02)。在非鳞癌研究中,中位PFS多西他赛组优于纳武单抗组(4.2个月 vs 2.3个月),但是1年的PFS纳武单抗组优于多西他赛组(19%vs8%)。在鳞癌组,PD-L1表达既不能预测预后也不能预测疗效[7]。相反,在非鳞癌组,PD-L1的表达在纳武单抗组中有更长的OS,表明在这些患者中治疗效果存在差异[6]。在两项试验中,纳武单抗与多西他赛治疗相关毒性反应(≥3级)均较少[6,7]。
帕博利珠单抗是用一项大型多队列Ⅰ期试验进行评估,试验纳入了以前治疗过的患者(KEYNOTE-001)[24],实验取得了可喜的结果,随后进行了Ⅱ/Ⅲ期试验,即KEYNOTE-010[27]。实验对比了在既往接受过治疗PD-L1表达≥1%(n=1 034)的NSCLC患者,每3周使用1次帕博利珠单抗(2和10 mg/kg)或多西他赛(75 mg/m2),在所有试验队列中包括鳞癌(19-22%)和非鳞癌(70-71%)。交叉治疗队列中40%~44%的患者高表达PD-L1(≥50%)。在PD-L1≥1%的人群中,帕博利珠单抗组(2或10 mg/kg)和多西他赛组(3.9个月 vs 4个月)之间的中位无进展生存期(PFS)没有显著的差异。然而,两种剂量(2 mg/kg — 10.4 个月;HR,0.71; 95% CI,0.58–0.88; P=0.0008; 10 mg/kg—12.7 个月;HR,0.61; 95% CI,0.49–0.75; P<0.0001)帕博利珠单抗组的中位OS与多西他赛组(8.5个月)相比较均显著改善。在PD-L1≥50%的患者中,与多西他赛组(PFS,4.1 个月,OS,8.2 个月)相比帕博利珠单抗组(2 mg/kg-PFS 5.0 个月;HR,0.59; P=0.0001;OS,14.9 个月;HR,0.54; P=0.000 2; 10 mg/kg—PFS 5.2 个月;HR,0.59;P<0.000 1;OS,17.3 个月;HR,0.50; P<0.000 1)的PFS和OS显著延长。在PD-L1≥1%的人群中,两种剂量的帕博利珠单抗组的反应率较多西他赛显著提高(两种剂量的帕博利珠单抗组vs 多西他赛组为18% vs9%;2mg/kg,P=0.000 5;10mg/kg,P=0.000 2)。在PD-L1≥50%的患者中,两种剂量的帕博利珠单抗组(帕博利珠单抗2 mg/kg vs 多西他赛:30% vs 8%;帕博利珠单抗10mg/kg vs多西他赛:29% vs 8%;两者的P<0.000 1)的反应率与多西他赛组相比会显著升高。与多西他赛组(35%)相比,两种剂量的帕博利珠单抗的3~5级治疗相关不良反应(AEs)较少发生(剂量为2 mg/kg不良反应发生率为13%,10 mg/kg的不良反应发生率为16%)。这个数据表明帕博利珠单抗可在先前治疗的PD-L1≥1%的晚期NSCLC患者中作为二线或后期治疗,该实验也表明PD-L1高表达患者的免疫治疗获益更多[27]。
阿替利珠单抗已在一系列实验中得到评估,如BIRCH(16)、POPLAR(28)和OAK(10)。BIRCH是阿替利珠单抗在ⅢB/Ⅳ期或复发性NSCLC并且PD-L1表达≥5%的患者中使用的Ⅱ期试验。如上所述,这项多队列研究还包括既往接受过治疗的两个队列患者:二线和三线或更高。结果基本证明单药阿替利珠单抗在治疗PD-L1选择性晚期NSCLC的有效性和安全性[16]。
POPLAR是一项随机Ⅱ期试验,对比了含铂化疗进展后的 NSCLC 患者中(n = 287)阿替利珠单抗(1200mg静滴)与多西他赛的治疗效果。该实验招募了非鳞癌和鳞癌,并且根据PD-L1 表达(<1%,≥1% 和 <5%,≥5% 并且 < 50%,并且≥50%)分层,在意向治疗(ITT)中,与多西他赛比较,阿替利珠单抗的OS显著延长(12.6个月与9.7个月;HR,0.73;95%CI,0.53–0.99; P=0.04)。值得注意的是,鳞和非鳞NSCLC患者中使用阿替利珠单抗的OS与多西他赛比较,都有显著改善,两组的PFS相似(2.7个月与 3.0个月;HR,0.94;95% CI,0.72–1.23),两种之间的ORR也相似。但是与多西他赛足(7.2个月)相比,阿替利珠单抗足(14.3个月)改善了中位反应持续时间。与其他免疫检查点抑制剂观察到的一样,PD-L1的表达增加与阿替利珠单抗的OS获益相关。在没有PD-L1(<1%)表达的患者中,OS在阿替利珠单抗组和多西他赛组相似(9.7个月;HR,1.04;95%CI,0.62-1.75)。在PD-L1≥1%的患者中,在观察到的总效益方面和生存率有显著改善。与多西他赛比较,阿替利珠单抗的3-4级治疗相关不良反应较少发生(11% vs 39%)[28]。
OAK是一项Ⅲ期研究,为了进一步验证POPLAR研究结果,总体设计非常相似。这个试验对比阿替利珠单抗和多西他赛治疗曾接受过至少一种含铂类的细胞毒化疗方案的ⅢB期或Ⅳ期的NSCLC(n=850)。试验根据PD-L1的表达对患者进行分层。ITT人群中使用阿替利珠单抗组中位OS比多西他赛组更长(13.8 vs 9.6 个月; HR,0.73; 95% CI,0.62–0.87; P=0.0003)。然而,与POPLAR研究相比,在PD-L1≥1%的患者中,与多西他赛比较,阿替利珠单抗的中位OS显著改善(15.7 个月 vs 10.3 个月;HR,0.74; 95% CI,0.58–0.93; P=0.0102)。在PD-L1<1%的患者中,使用阿替利珠单抗的中位OS也显著延长(12.6 个月与 8.9 个月;HR,0.75;95% CI,0.59–0.96)。与之前的研究结果一致,阿替利珠单抗在PD-L1高表达(≥50%)患者身上能够达到最大的中位OS(20.5个月 vs 8.9个月;HR,0.41; 95% CI,0.27–0.64; P<0.0001)。在ITT人群中使用阿替利珠单抗和多西他赛的中位PFS相似(2.8 个月vs.4.0 个月;HR 0.95; 95% CI,0.82–1.10)。客观反应率在两组之间也相似,但与多西他赛组相比阿替利珠单抗组的中位反应持续时间显著延长(16.3 个月 vs 6.2 个月;HR,0.34; 95% CI,0.21–0.55; P<0.000 1)。阿替利珠单抗组的3级或4级治疗相关不良反应(TRAEs)的发生频率较多西他赛组更低(15% vs 43%)[10]。
BIRCH、POPLAR 和 OAK研究的一个显着区别是纳入了 EGFR 突变和 ALK 易位的患者,这些患者被排出在其他免疫治疗研究。BIRCH纳入32名(15%)EGFR突变的患者接受二线或二线以上的治疗[16];POPLAR研究中,纳入19例(13%)EGFR阳性患者,在阿替利珠单抗组中占13%、多西他赛组中占10%(28);OAK试验中包括85名患者(每个治疗组占10%)[10]。ALK阳性患者入组更少:BIRCH中有6名(4%)[16]、POPLAR中有3名(5%)[28]、OAK中有2名(<1%)[10]。考虑到入组患者数量少,所以所得结论有局限性。OAK试验亚组分析显示,EGFR突变患者化疗要优于阿替利珠单抗(HR,1.24;95% CI,0.21–2.18),表明对这些患者免疫检测点抑制剂没有获益[10]。
Ⅲ期非小细胞肺癌的免疫治疗
免疫检查点抑制剂的最新进展是用于治疗局部晚期、III期非小细胞肺癌。目前的标准治疗组合是化疗联合放疗。同时,如果可以忍受,建议同期进行放化疗,尽管序贯治疗也是一种选择。
PACIFIC 是一项Ⅲ期试验,评估了度伐利尤单抗在放化疗后维持治疗1年的效果。全部患者接受了至少2个周期的含铂为基础的同步放化疗。放化疗后无疾病进展的709例患者被随机分配到度伐利尤单抗组(10 mg/kg Ⅳ)或安慰剂组每2周一次,持续12个月。度伐利尤单抗治疗开始于放化疗完成后的42天。大多数患者在随机分配入组之前,大多数达到部分有效(度伐利尤单抗组48.7%、安慰剂组46.8%)。度伐利尤单抗组的中位PFS较安慰剂显著延长(16.8 个月vs 5.6 个月;HR,0.52; 95% CI,0.42–0.65;P<0.001)。值得注意的是,度伐利尤单抗的PFS获益与PD-L1表达无关。与安慰剂相比,度伐利尤单抗组的反应率明显更好(28.4% vs 16%;P<0.001)。在度伐利尤单抗组和安慰剂组3或4级的与治疗相关的AE是相似的(29.9% vs 26.1%)。尽管,度伐利尤单抗组的肺炎发生率更高(所有级别:33.9% vs25.2%)[29]。基于这些结果,度伐利尤单抗已在美国获批用于同步放化疗后Ⅲ期非小细胞肺癌的后续治疗。
联合治疗及未来方向
正在进行的研究领域包括跨越多条治疗线的组合疗法。其中一个领域是将免疫疗法推向疾病的早期。表2 总结了新辅助治疗、辅助治疗和放化疗在早期非小细胞肺癌中正在进行的临床试验。这些试验包括:评估免疫疗法联合立体定向放射治疗不可切除的早期肺癌,诱导治疗潜在可切除的肺癌和接受放化疗后的局部晚期患者的巩固治疗。
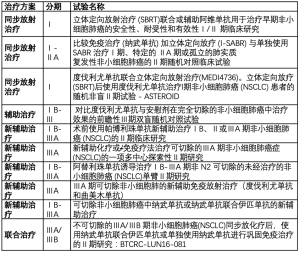
Full table
另一个热门领域是找出组合疗法解决耐药问题。 虽然免疫检查点抑制剂已显示出可喜的临床效果,大多数患者没有达到持续的有效,并且最终死于疾病进展。 此外,尽管更多患者在早期接受免疫检查点抑制剂治疗,其选择也仅限于化疗进展。解决这个问题的策略包括联合疗法——免疫调节联合:如将 PD-1/PD-L1 抑制剂与 CTLA-4抑制剂结合使用,另加放射治疗的远隔效应,或添加其他免疫调节剂。这些试验仍在进行中,但可能代表下一代抗癌疗法。
结论
免疫检查点抑制剂免疫疗法改变了NSCLC 的治疗和提高晚期患者的生存率。免疫检查点抑制剂可做为转移性非小细胞肺癌的一线或二线标准治疗。 随着这种治疗方式的不断发展,它也可能影响早期肺癌的治疗。随着未来的研究,我们不断丰富,对耐药机制和预测性生物标志物的理解,将进一步开发这些新药在非小细胞肺癌治疗中的使用。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/shc.2018.04.06). Dr. Bertino reports personal fees from Pfizer, null, outside the submitted work. Dr. George has no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- World Health Organization. Cancer fact sheet. 2018. Available online: http://www.who.int/mediacentre/factsheets/fs297/en/
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin 2018;68:7-30. [Crossref] [PubMed]
- Gubin MM, Zhang X, Schuster H, et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature 2014;515:577-81. [Crossref] [PubMed]
- Mahoney KM, Rennert PD, Freeman GJ. Combination cancer immunotherapy and new immunomodulatory targets. Nat Rev Drug Discov 2015;14:561-84. [Crossref] [PubMed]
- Nishimura H, Honjo T. PD-1: an inhibitory immunoreceptor involved in peripheral tolerance. Trends Immunol 2001;22:265-8. [Crossref] [PubMed]
- Borghaei H, Brahmer J. Nivolumab in Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2016;374:493-4. [PubMed]
- Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015;373:123-35. [Crossref] [PubMed]
- Carbone DP, Reck M, Paz-Ares L, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer. N Engl J Med 2017;376:2415-26. [Crossref] [PubMed]
- Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol 2016;17:1497-508. [Crossref] [PubMed]
- Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017;389:255-65. [Crossref] [PubMed]
- Remon J, Chaput N, Planchard D. Predictive biomarkers for programmed death-1/programmed death ligand immune checkpoint inhibitors in nonsmall cell lung cancer. Curr Opin Oncol 2016;28:122-9. [Crossref] [PubMed]
- Buchbinder EI, Desai A. CTLA-4 and PD-1 Pathways: Similarities, Differences, and Implications of Their Inhibition. Am J Clin Oncol 2016;39:98-106. [Crossref] [PubMed]
- O'Day SJ, Hamid O, Urba WJ. Targeting cytotoxic T-lymphocyte antigen-4 (CTLA-4): a novel strategy for the treatment of melanoma and other malignancies. Cancer 2007;110:2614-27. [Crossref] [PubMed]
- Boasberg P, Hamid O, O'Day S. Ipilimumab: unleashing the power of the immune system through CTLA-4 blockade. Semin Oncol 2010;37:440-9. [Crossref] [PubMed]
- Hellmann MD, Rizvi NA, Goldman JW, et al. Nivolumab plus ipilimumab as first-line treatment for advanced non-small-cell lung cancer (CheckMate 012): results of an open-label, phase 1, multicohort study. Lancet Oncol 2017;18:31-41. [Crossref] [PubMed]
- Peters S, Gettinger S, Johnson ML, et al. Phase II Trial of Atezolizumab As First-Line or Subsequent Therapy for Patients With Programmed Death-Ligand 1-Selected Advanced Non-Small-Cell Lung Cancer (BIRCH). J Clin Oncol 2017;35:2781-9. [Crossref] [PubMed]
- Paz-Ares L, Brahmer J, Hellmann MD, et al. CheckMate 227: A randomized, open-label phase 3 trial of nivolumab, nivolumab plus ipilimumab, or nivolumab plus chemotherapy versus chemotherapy in hemotherapy-naive patients with advanced non-small cell lung cancer (NSCLC). Annals of Oncology 2017;28:ii28-51.
- Merck Sharp & Dohme Corp. A Study of Carboplatin-Paclitaxel/Nab-Paclitaxel Chemotherapy With or Without Pembrolizumab (MK-3475) in Adults With First Line Metastatic Squamous Non-small Cell Lung Cancer (MK-3475-407/KEYNOTE-407). 2017. Available online: https://clinicaltrials.gov/ct2/show/NCT02775435
- Govindan R, Szczesna A, Ahn MJ, et al. Phase III Trial of Ipilimumab Combined With Paclitaxel and Carboplatin in Advanced Squamous Non-Small-Cell Lung Cancer. J Clin Oncol 2017;35:3449-57. [Crossref] [PubMed]
- Juergens RJ, Hellmann MD, Brahmer JR, et al. First-Line Nivolumab plus Platinum-Based Doublet Chemotherapy for Advanced NSCLC: CheckMate 012 3-Year Update. World Conference on Lung Cancer, October 2017; Yokohama, Japan.
- Gettinger S, Rizvi NA, Chow LQ, et al. Nivolumab Monotherapy for First-Line Treatment of Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2016;34:2980-7. [Crossref] [PubMed]
- Reck M, Rodriguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016;375:1823-33. [Crossref] [PubMed]
- Hui R, Garon EB, Goldman JW, et al. Pembrolizumab as first-line therapy for patients with PD-L1-positive advanced non-small cell lung cancer: a phase 1 trial. Ann Oncol 2017;28:874-81. [Crossref] [PubMed]
- Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 2015;372:2018-28. [Crossref] [PubMed]
- Hall RD, Gadgeel SM, Garon EB, et al. Phase 3 study of platinum-based chemotherapy with or without pembrolizumab for first-line metastatic, nonsquamous non-small cell lung carcinoma (NSCLC): KEYNOTE-189. J Clin Oncol 2016;3:abstr TPS9104.
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015;373:1627-39. [Crossref] [PubMed]
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016;387:1540-50. [Crossref] [PubMed]
- Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016;387:1837-46. [Crossref] [PubMed]
- Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 2017;377:1919-29. [Crossref] [PubMed]

郝瑞清
2020年硕士毕业于哈尔滨医科大学,是一名中共预备党员,研究方向为:单核细胞表达ABHD2含量与慢性阻塞性肺疾病患者感染的相关性分析。本科阶段,作为社区糖尿病患者调查小组的小组长,进行糖尿病相关研究。硕士研究生期间参与了导师国自然的撰写。2020年10月份入职南方医科大学南方医院增城分院,2020-9-4参加了(第二届)南香山肺癌规范化诊治学习班暨广东省预防医学会呼吸预防与控制专业委员会肺癌学组学术沙龙。工作后,参加了2020年于深圳举办的第二十一届全国呼吸病学学术会议,聆听了专业领域内各位大咖的精彩演讲。2021-3-25于广州粤海喜来登酒店参加了GSK慢性气道炎症规范管理与创新治疗学术论坛。2021-3-23至2021-3-25成功报名参加了由广东省钟南山医学基金会主办,中华医学会呼吸病学分会慢性阻塞性肺疾病学组、中国慢阻肺联盟和深圳市人民医院共同协办的“润物有声-中国慢阻肺临床科研研修班”。同时在工作之余还参加了多场学术会议。(2021/10/4)
李泽树
北大医疗鲁中医院(更新时间:2021/8/6)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: George TL, Bertino EM. The role of immune checkpoint inhibitors in non-small cell lung cancer. Shanghai Chest 2018;2:35.


