全肺袖状切除术的适应证和技巧
介绍
全肺袖状切除术是一种具有挑战性的外科手术,用于切除涉及肺、下气管、隆突和气管支气管分叉的癌症。最常见的适应证是非小细胞肺癌、支气管癌、类癌瘤、囊腺癌或炎性狭窄。其他常见的适应证是标准全肺切除术后切缘阳性。
由于手术复杂而且危险并发症多,这种类型的手术目前仍然很少见。最近手术技术、不同通气方式和术后管理的改进大大降低了死亡率和并发症发生率,尤其是在手术量大的中心[1]。
仔细选择患者是手术成功的关键(表1)。绝对禁忌证包括:肺功能储备不足、心功能不能耐受、N2/N3淋巴结阳性和气管受累过长[2]。

Full table
相对禁忌证包括:接受过新辅助放疗(>45 Gy)和使用皮质醇激素,这样增加会吻合口瘘的风险。
技巧
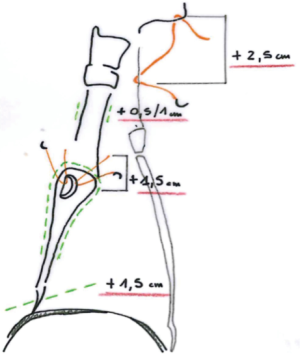
- 术前支气管镜和CT评估:只有肿瘤累及不超过主支气管1.5 cm或远端气管2.5~3.5 cm时,才能进行无张力吻合。为了降低吻合口瘘的风险,气道切除的总距离必须小于4 cm。
- 术前至少停用皮质醇激素3~4周。
- 应在计划手术的同时进行纵隔镜检查,以防止纵隔瘢痕形成,可能会降低气管移动性[3]。
- 也不建议重复纵隔镜检查,以免影响气管血运(devascularization)。
- 纵隔分期计划在手术前较长一段时间进行时,EBUS是一种可靠的淋巴结分期技术,具有较高的敏感性和特异性,并且可以避免疤痕或影响血运的问题。
麻醉方法
准备
在这种情况下,外科医生和麻醉医生之间的合作是基础[4]。
有几种不同类型的通气方式可供选择:
- 长的、带支撑的、可弯曲的单腔气管插管:手术开始时放置在气管中。手术过程中它可以向前插入左或右主支气管。 一旦气管被横断,将通过穿过术野的一根无菌气管插管连接主支气管进行通气,麻醉医生将其与无菌管道系统连接。
- 在手术吻合过程中,管子可以间歇性滑出。支气管后壁吻合完成后,可取出术野内的插管,将原气管插管插入主支气管。
- 可单肺通气的双腔管:这种类型的管较硬,难以通过远端隆突。
- 高频喷射通气:一种机械通气技术,使用非常高的频率(> 100次/分钟)和小潮气量(100~150mL/分钟),通过可回收的单腔或双腔细插管将气体输送到主支气管。这种技术可以保证通气而不会产生气压伤,但可能会导致二氧化碳潴留。由于导管直径小,手术重建要容易得多[4]。
- 间歇性通气暂停通气:当血氧饱和度降低时,穿过开放气道插管,用100%氧气对患者进行过度通气。血氧饱和度升高,撤出插管外科医生继续进行吻合。
- 细长的45 cm单腔管,带有自膨式气囊。
- 体外循环/ECMO:根据我们的经验,最好在没有这些支持的情况下行全肺袖状切除术。体外膜肺氧合的使用仅限于单肺通气气体交换不足或手术期间大出血。
手术入路
胸骨正中切开、前外侧开胸、后外侧开胸、双侧开胸、半蛤壳或蛤壳式切口(hemi-clamshell or clamshell)可用于接近下段气管、隆突和气管支气管分叉。
切口类型因肿瘤部位而异,而患者的体位取决于切口选择。
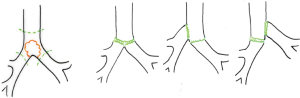
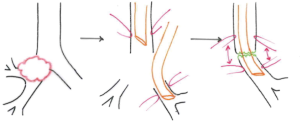
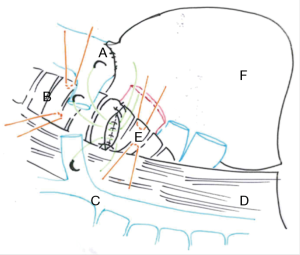
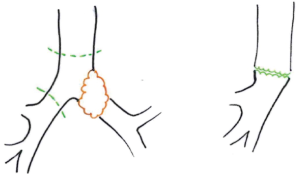
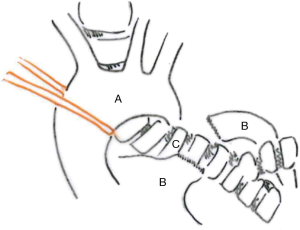
本章我们不讨论没有肺切除术的隆突重建,所以我们只列举了下面的主要几种重建类型(图1)[5]。
右全肺袖式切除隆突重建术
右全肺袖式切除术是最常见的全肺切除隆突重建术。几种手术方法都是可行的,取决于外科医生的经验以及局部病理状况(图2~图3)。
经胸入路
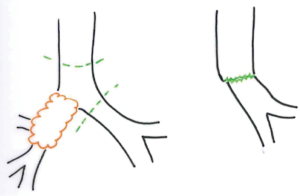
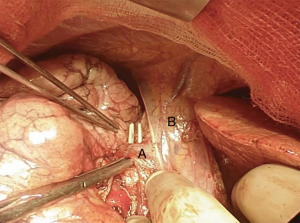
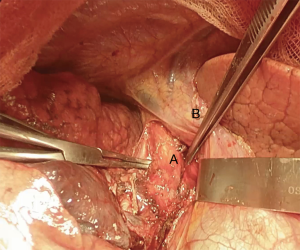
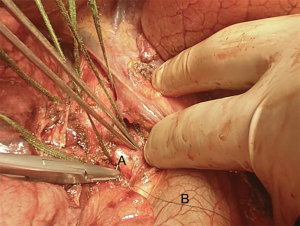
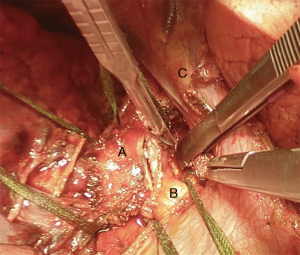
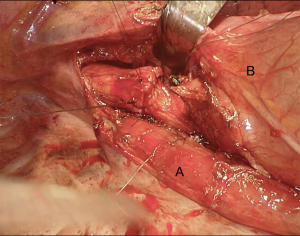
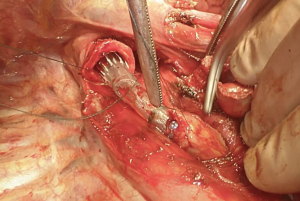
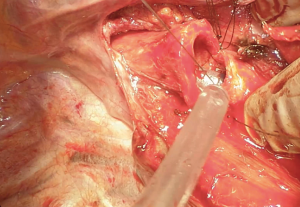
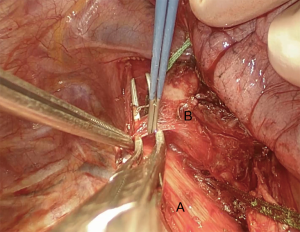
我们采用标准的右侧第四肋间后外侧开胸切口。首先,我们将下肺韧带分开以游离整个肺(图4)。切断奇静脉以更好显露隆突(图5~图6)。我们分离气管前平面,打开心包,悬掉两侧的气管和主支气管(图7~图8)。建议术中使用支气管镜来确定肿瘤的近端和远端以及横断气道的部位。通气,我们更喜欢使用描述的第一种方法,放置穿过术野的一根无菌气管插管(图9)。拔出气管插管、横断气管。中外侧壁留置2-0缝线(图10)。然后,切断左主支气管并检查(图11)。右肺动、静脉套线并结扎。

随后,我们整体移除标本并开始重建。因此冷冻切片检查支气管切缘是必须的:在阳性切缘的情况下,须在R0切除和重建气道之间取得平衡。
2-0或3-0可吸收减张线放置在气管壁上以稳定结构并使外科医生感受到缝合线的张力(图12)[2]。
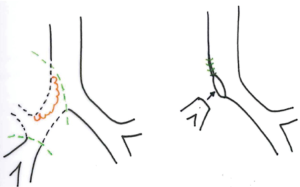
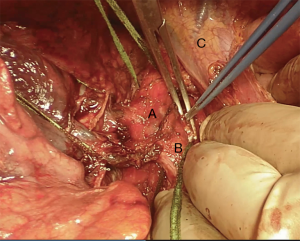
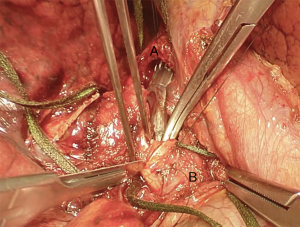
有几种方法可以进行吻合:我们更喜欢使用4-0可吸收线间断缝合,在外面打结(图13),从后排开始,在前排结束,从后面开始在缝线的相对位置以对称顺序逐渐打结。通过将支气管腔切口延长来纠正远端气管和左主支气管之间的任何大小差异[6]。
在缝合之前,患者的颈部弯曲(图14),使远端气管靠近相对固定的左主支气管。事实上,这适用于任何吻合术,对于组织愈合而言减少张力是至关重要的。用纤维支气管镜检查吻合,并通过带蒂的胸膜或心包脂肪瓣包绕缺乏血运的吻合口[2]。
经胸骨入路
患者仰卧、颈部伸展、双臂外展。正中胸骨切开术以标准方式进行,但切口可以向头侧延伸,以便更好地控制左头臂静脉[7]。初步解剖后,左头臂静脉和动脉游离和套带。打开心包前壁。游离升主动脉、套带并向左牵拉,而上腔静脉向右侧牵拉,以暴露气管。仔细游离气管前平面,以避免影响血运。之后,我们到达侧面的右肺动脉,解剖并将其与主支气管分开[8]。
横断动脉和静脉,心包后壁被切开以更好暴露气管。将远端气管和近端支气管沿圆周切开并悬吊。为了增加气管的移动性,我们建议此时进行广泛的淋巴结清扫。
我们建议进行术中进行支气管镜检查以确定肿瘤累及范围并决定在哪里横断气管。左主支气管被横断和检查。中外侧用2-0缝线以稳定结构,并放置一个穿过术野的无菌气管插管用于左肺通气。拔出气管插管并横断气管进行右全肺切除术。
用2-0缝线缝合在气管中外侧壁上以稳定结构。用可吸收4-0缝线间断缝合,通常从膜的中线向中外侧缝合(图15~图16)[2]。
颈部弯曲使横断气道的两部分靠拢。因为无张力吻合是关键点,如果组织牵引似乎过度,则有必要进一步气管或左主支气管。最终可以进行左肺门松解,否则通常通过左前开胸术(在下肺静脉下方或周向切开心包)进行该手术[8]。
然后以我们之前描述的相同方式打结。吻合完成后,将原来的气管插管推入缝线上方以进行标准通气。
蛤壳式切口入路
蛤壳式切口暴露胸腔器官与胸骨正中切开术相似,但蛤壳形切口更大地暴露双侧胸膜腔和肺门,并充分暴露气管后表面。当气道重建面临断端间距过大时,这种方法有利于最大程度游离左肺门。
顺序行后外侧开胸术或左侧电视辅助胸腔镜(VATS)联合右侧开胸手术是蛤壳式切口入路的替代方案。
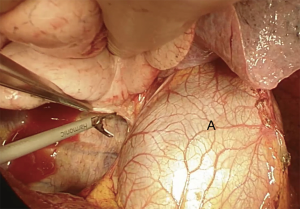
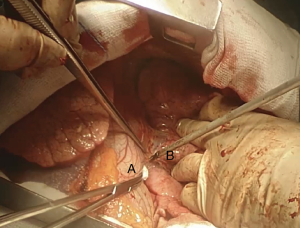
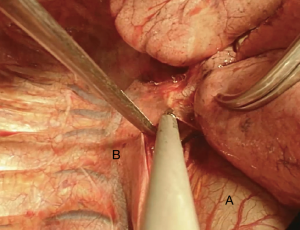
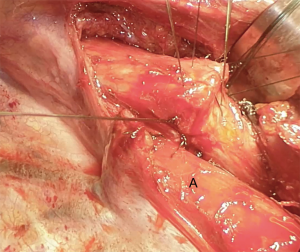
图例是一个临床病例的简要摘要(图4,图6~图8,图10~图11,图13,图15~图21)。这是一例 41 岁女性患者,右主支气管腺样囊性瘤累及隆突和左主支气管近心端1 cm。由于需要切除大段气管,这种袖式右全肺切除术的最佳入路是蛤壳式切口。通过最大可能游离肺门来使左主支气管达到最大活动度。
VATS入路
最近有报道袖式右全肺切除术的VATS入路。由于技术上的挑战,这些少数病例报道仅限于单个作者的经验。非常短的隆突切除似乎是这种方法的主要适应证[9,10]。
左全肺袖式切除术
由于左主支气管的长度以及这一侧的肿瘤经常侵及主动脉下间隙,这种手术(图22)的数量远少于右肺。
此外,左全肺袖式切除重建的挑战性在于主动脉弓遮挡下段气管和右主支气管[6]。手术可以通过不同的入路进行。对于每个病例重要的是避免影响气管和主支气管血运,并通过尽可能松解减少吻合口张力。
开胸手术入路
当肿瘤侵犯左主支气管而隆突受累局限时,左开胸手术是最佳选择。可以很好地显露胸腔,并能充分游离后纵隔[6]。
取左侧第四肋间左后外侧切口。将主动脉悬吊并向头外侧牵拉以暴露主肺动脉窗(图23)。分离肺动脉和主动脉。解剖分离气管和右主支气管的前外侧平面。
完整进行淋巴结清扫,分离肺门动静脉血管。
气管和左、右主支气管套带。
将一根穿过术野的无菌气管插管插入切断的右侧支气管进行右肺通气。完成左全肺切除术。
用2-0可吸收缝线减张缝合远端气管和右主支气管。用4-0线间断缝合一圈,线结打在外面,从离外科医生最远的点开始。在打结之前,所有的缝线都按顺序缝好。
气管和右支气管之间的管径不匹配应在每一针中进行调整,而不是剪修切缘[2]。患者的下巴弯曲以接近吻合口。 首先,最好是打紧减张线,然后是软骨侧缝线,膜部缝线最后收紧。
胸骨入路
正中胸骨切口可以双侧进入纵隔,气管前部暴露良好(尽管主动脉弓这部分纵隔不能显露)。另一方面,左肺静脉的控制更困难,进入后纵隔受限,主动脉弓的遮挡,不能暴露整个气道表面。
胸骨正中切开后,打开前心包。上腔静脉套带并向右牵拉,主动脉向左牵拉暴露心包后壁。
为了更好暴露左主支气管,必须将主动脉拉向右侧:这种操作得以分离和切开右肺动脉,然后是两条肺静脉(图23)[5]。
气管插管被撤出,气道分为两个切缘:气管远端和右支气管近端。从而完成左全肺切除术。右肺通过一根穿过术野的无菌气管插管进行通气。我们建议通过松解肺门和解剖覆盖右支气管和气管的组织来增加气管前平面的活动度。常规在两侧缝合减张牵引线。
与经胸入路不同,在这种情况下,用4-0缝线间断吻合应先在从气管膜部开始并在里面打结。之后缝合气管软骨并在外面打结。
蛤壳切口入路
蛤壳切口入路与之前的右全肺袖式切除术具有相同的优势;此外,结合从前面暴露纵隔与从侧面暴露左侧胸膜腔使得这种入路对左全肺袖式切除术特别适合。
组合入路
左全肺切除术与隆突切除术的巧妙组合方法:胸腔镜辅助下左全肺切除,右侧开胸行隆突切除和气管、右主支气管成形术[9,10]。
术后常用辅助手法及护理
建议吻合口预防性覆盖,特别是吻合口前面缝线部位完全去血管化处;常用的是包埋组织心包脂肪、胸膜瓣、奇静脉瓣或肋间肌瓣。将吻合口没入温生理盐水来检测是否漏气。常规行系统性淋巴结清扫。
当气管切除较长时,建议在下巴和胸骨柄上的皮肤之间放置一根粗线,以限制患者颈部在术后早期(约7天)伸展以保护吻合口[2]。
护理从手术后的支气管镜检查开始,以检查吻合口并清理分泌物。大多数患者在手术室拔管。护理的重点是系统性排痰,包括早期下床活动、连续支气管镜检查和理疗。
我们建议使用硬膜外麻醉已获得最佳镇痛效果。
推荐围手术期使用广谱抗生素,其持续时间取决于临床状态和分泌物的性质。需要控制静脉输液以避免液体超负荷。
部分术者建议使用β受体阻滞药或钙通道阻滞药来预防房性心律失常。
出院前用支气管镜来检查吻合口状况(术后约7天)。
技巧和窍门
- 经胸骨入路可以从两侧处理气道,是气管远端肿瘤累及很少主支气管(<2 cm)的良好选择。
- 预计切缘气道外侧游离范围(<2 cm)要限制以避免影响血运(<2 cm)。同样,在淋巴结清扫过程中务必注意。
- 为了避免在解剖过程中损伤左喉返神经,建议尽量贴近气管分离。
- 为了减少吻合的张力,一个好的方法是解剖气管前平面(通常在纵隔镜检查期间)并松解肺门(图4,图8,图18~图19)。
- 术中支气管镜检查对确定肿瘤范围非常有帮助。使用透射或经支气管穿刺来标记确切的点。
- 气管和主支气管的横断面必须与轴线垂直。
- 气管完整一周切除,避免两个切缘之间残留气管软骨残端。
- 切缘到肿瘤的距离应>1 cm。
- 不要修剪气管或支气管来纠正口径差异。
- 减张线不应放在气管膜部,因为在打结时可能会撕裂。
- 许多术者更喜欢在膜部使用连续缝合,软骨部分使用间断缝合。
- 近端和远端切缘必须进行术中冰冻切片检查。
- 用肋间肌瓣、心包或心包周围脂肪包裹吻合口。
- 吻合后立即用支气管镜检查吻合口。
- 在少数病例中,可以在最初几天进行临时气管切开术,以直接吸出气道分泌物。
评论
并发症
死亡的主要原因是呼吸衰竭:
成人呼吸窘迫综合征 (ARDS) 和全肺切除术后肺水肿:10% 的患者在最初 72 小时内发生,死亡风险为 90%。原因尚不清楚,但可能是全身炎症反应、气压伤、液体超负荷和淋巴管回流障碍的综合结果。预防措施包括最大限度降低肺动脉压力、最大限度降低气道平均和峰值压力、利尿药、无创通气和限制液体入量。
- 吻合口裂开:发生率为11%~17%,主要与张力、吻合技术不过关或术中血运障碍造成的缺血有关。总死亡率接近44%。如果有任何紧急吻合口漏的证据,则必须进行手术修复。如果发生裂开,需要通过气管内插管保护气道,广谱抗生素治疗并放置胸腔引流管引流全肺切除后的残腔或进行开放式胸廓造口术。坏死和缺血可以用高压氧治疗。后期狭窄和肉芽生成被认为是晚期并发症,可以用球囊扩张术,或者最后通过支架植入来解决[11]。
- 声音嘶哑:损伤喉返神经引起声带麻痹是可能的,但通常是暂时的,数月后会自行恢复。下巴收拢动作可用于改善通气防止误吸。气管游离过程中要十分小心以避免神经损伤[12]。
- 并发症的最佳治疗方法仍然是预防。
肿瘤侵犯上腔静脉会增加技术难度和发生并发症风险。
结果
随着时间的推移,全肺袖状切除术的结果有所改善,有经验的中心相对安全。现在,若患者选择合适,围手术期死亡率为7%~10%,并发症率和死亡率与标准全肺切除术非常接近。
纵隔淋巴结受累是主要的预后因素:N2/N3淋巴结转移的长期预后仍然很差,5年生存率为12%~15%[1]。如果纵隔淋巴结阴性,则存活率达到53%。这些数据强调了术前纵隔分期的重要性[3]。因此,术前分期显示淋巴结受累(ⅢB 期),那么对这些患者进行手术能否获益是有疑问的。(见禁忌证)[13]。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Marco Scarci, Alan D.L. Sihoe and Benedetta Bedetti) for the series “Open Thoracic Surgery” published in Shanghai Chest. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/shc.2017.08.11). The series “Open Thoracic Surgery” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- de Perrot M, Shields TW, LoCicero J, et al. Tracheal Sleeve Pneumonectomy. In: Shields TW, LoCicero J, Reed CE, et al. editors. General Thoracic Surgery. 7th Edition. Ambler: Lippincott Williams & Wilkins, 2009.
- Grillo HC. Surgery of the trachea and bronchi. London: BC Decker Inc., 2004
- Silvestri GA, Gonzalez AV, Jantz MA, et al. Methods for staging non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143:e211S-e250S.
- Young-Beyer P, Wilson RS. Anesthetic management for tracheal resection and reconstruction. J Cardiothorac Anesth 1988;2:821-35. [Crossref] [PubMed]
- Ginsberg RJ. Carinal Resection and Sleeve Pneumonectomy Using a Transsternal Oper Tech Thorac Cardiovasc Surg 1998;3:203-16. [Crossref]
- Dartevelle P, Macchiarini P. Techniques of pneumonectomy. Sleeve pneumonectomy. Chest Surg Clin N Am 1999;9:407-17. xi. [PubMed]
- Grillo HC. Carinal reconstruction. Ann Thorac Surg 1982;34:356-73. [Crossref] [PubMed]
- Weder W, Inci I. Carinal resection and sleeve pneumonectomy. J Thorac Dis 2016;8:S882-S888. [Crossref] [PubMed]
- Gonzalez-Rivas D, Yang Y, Stupnik T, et al. Uniportal video-assisted thoracoscopic bronchovascular, tracheal and carinal sleeve resections†. Eur J Cardiothorac Surg 2016;49:i6-16. [PubMed]
- Ai B, Liao Y, Zhang Z, et al. Single-stage bilateral thoracic surgery via a combined VATS and open approach for left central bronchogenic carcinoma with carinal invasion: report of two cases. J Cardiothorac Surg 2015;10:76. [Crossref] [PubMed]
- Mathisen DJ, Morse C. Master Techniques in Surgery: Thoracic Surgery: Lung Resections, Bronchoplasty. Lippincott Williams and Wilkins, 2014.
- Banki F, Wood DE. Techniques of Performing Left Carinal Pneumonectomy. Oper Tech Thorac Cardiovasc Surg 2007;12:194-209. [Crossref]
- Dartevelle PG, Macchiarini P, Chapelier AR. 1986: Tracheal sleeve pneumonectomy for bronchogenic carcinoma: report of 55 cases. Updated in 1995. Ann Thorac Surg 1995;60:1854-5. [Crossref] [PubMed]

宁君伟
上海市胸科医院肿瘤外科住院医师。硕士,擅长肺部肿瘤、纵隔肿瘤等胸外科常见疾病的诊治,辅助双/多孔胸腔镜以及单孔3D胸腔镜手术,从事早期及局部晚期肺癌相关临床研究。以共一作者于Annals of Thoracic Surgery发表论著1篇,以共同作者发表SCI论著3篇,参与两项国家自然科学基金课题。(更新时间:2021/8/6)
李泽树
北大医疗鲁中医院(更新时间:2021/8/6)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Nosotti M, Righi I, Damarco F, Rosso L. Tracheal sleeve pneumonectomy: indications and surgical operative techniques. Shanghai Chest 2017;1:29.