肺段切除术
引言
定义
段(segment)这个词来源于拉丁语名词segmentum(被切断的一块),意思是更大结构的一部分。支气管肺段是肺实质的解剖和功能单位,由每个叶的亚区组成。每个段都有一个锥体结构,其顶端在肺门,基部在肺表面,供给来源包括(1)一个段支气管,即支气管树的三级分支;(2)肺动脉的段分支(以及支气管动脉);(3)肺静脉的段(±段裂)分支和淋巴管。
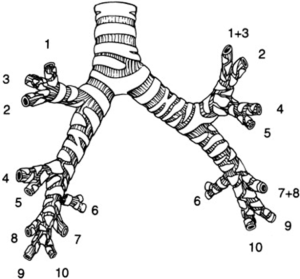
段切,或肺段切除术,是一种基于支气管血管解剖学、根据其解剖标志切除部分肺的技术。它包括所有支气管、血管段的切割和闭合,然后沿着段间平面剥离和切除肺实质。任何外科医生在进行单肺段切除术之前,都必须对人体肺的解剖结构有全面的了解。右肺共10段(上叶3段,中叶2段,下叶5段),左肺共9节段(上叶5段,下叶4段)(图1)。
指征
Churchill和Belsey于1939年首次描述了支气管扩张患者的肺段切除技术[1]。由于全肺切除术在1950年之前仍是肺癌患者的标准术式,这种切除方式最初仅限于支气管扩张或肺结核等感染性疾病患者。该术式应优先用于对于简单的楔形切除术而言,位置靠中心、局限于肺段的良性病变,例如,支气管扩张、肺脓肿、肺隔离症、良性肿瘤(错构瘤)或位于中心的转移性病变。在抗生素和抗结核药物广泛使用的现代肺外科时代,为感染性肺病变进行的肺段切除术数量已显著减少。
1973年,Jensik和Faber发表了一系列肺段切除肺癌患者的文章,质疑当时已经存在的肺叶切除标准[2]。随着螺旋计算机断层扫描(CT)筛查的引入,越来越多的早期肺癌和癌前病变被发现。这导致许多外科医生质疑肺叶切除术是否适用于所有非小细胞肺癌(non-small cell lung cancer,NSCLC)病例。在过去的20年里,早期肺癌的局部切除术,包括磨玻璃结节(GGO)、原位腺癌(AIS)和微浸润腺癌(MIA),一直是一个有争议的领域,不断有比较肺段切除术与标准肺叶切除术后生存率的非随机对照研究矛盾报道[3-5]。研究者为了提高支持小肿瘤(≤2.0 cm)局部切除的证据水平,建立了两项前瞻性随机研究,一项在美国和加拿大,预计5年内招募1 258名患者(CALGB-140503)[6],另一项在日本,3 年内累积了1 100名患者(JCOG0802/WJOG4607L)[7]。
有两组早期NSCLC患者可能受益于作为手术治疗的肺段切除术。第一组包括因肺功能测试不佳[1秒内用力呼气量(FEV1)低于预测值的50%]或有其他病变需要切除而不能耐受肺叶切除术的患者。较小范围的切除成了一种局部肿瘤的替代治疗,现在与其他侵入性较小的方法(如立体定向放疗或射频消融)竞争。第二组由可以耐受肺叶切除术的患者组成,但由于肿瘤体积小且淋巴结阴性,因此很可能采用亚肺叶切除术进行根治性切除。在正在进行的随机试验提供进一步证据之前,建议解剖性肺段切除术目前仅用于具有纯GGO病变或部分实性(<25%)病变(AIS、MIA)且<2cm、位于肺外周三分之一的健康患者。这些病变已知是非侵袭性的、没有恶性淋巴结扩散[3-5]。在切除肺段的情况下,肿瘤应位于典型肺段的中央部位,术中N1和N2淋巴结的冰冻切片应确认T1aN0M0分期情况。此外,外科医生应始终切除所有段间淋巴结并检查其无瘤状态。否则,该术式应转换为肺叶切除术。当肿瘤靠近段间平面(<1.0 cm)时,不应进行肺段切除术。因此,还建议对切缘进行冰冻病理检查。
方法
最初的肺段切除术包括开放手术,本文将进一步讨论。随着电视胸腔镜辅助下手术(video-assisted thoracic surgery,VATS)和机器人辅助下胸腔镜手术(robotic thoracic surgery,RATS)经验的增加,如今更多的肺段切除术正通过这些微创技术进行,特别是对于容易切除的肺段(S4-5和S6),据报道减少了术后并发症、30天死亡率和住院时间[8-11]。
术语
了解文献中用于描述要切除肺段序数和位置的命名法非常重要。典例和技术上最简单的外科手术是切除单个肺段(单肺段切除术),例如,下叶的背段(S6),也称为Nelson段或Fowler段。另一个例子是切除左上叶的两个基底段,相当于右中叶。由于左肺水平裂不存在(或不完整),该手术被称为肺叶切除术,而是双肺段切除术(bisegmentectomy)(S4-S5),更广为人知的名称是舌段切除术。上述手术更常见,尤其是对于分期为T1aN0M0的NSCLC。切除左上叶但保留舌段(相当于右上叶)被称为三肺段切除术(trisegmentectomy)(S1-S2-S3),有时也称为保留舌段的上叶切除术或茎尖切除术(culmenectomy)。最后,切除右下叶的4个节段(S7-S8-S9-S10)或左下叶的3个节段(S7&8-S9-S10)保留背段(S6)称为基底段切除术。
文献中也使用了不同的术语来描述肺实质切除的范围,但它们并不都对应相同的手术。由于其亚肺叶切除状态,楔形切除有时也称为非典型肺段切除术,它不是解剖性切除,不应与典型的解剖性肺段切除术混淆。这是一个重要的区别,因为非解剖性肺段切除术可能对早期肺癌患者的无瘤切缘、淋巴结取样和切除范围、局部复发和总生存率产生负面影响。这种非典型和典型肺段切除术的混淆污染了用于推荐肺段切除术作为恰当的癌症手术的系列数据。扩大的肺段切除术指的是切开肺实质在段间平面的侧面,以便在切缘与肿瘤直径比较有限的患者中获得更宽的切缘。
术前评估
与扩大的肺切除术(如肺叶切除术或全肺切除术)相比,术前心肺检查和评估医学可操作性的原则同样适用于肺段切除术。建议对每位接受肺切除术的患者进行心脏评估和肺功能测试,包括肺一氧化碳弥散量(DLCO)。对于一秒用力呼气量(forced expiratory volume in one second,FEV1)和/或DLCO<80%的患者,应进一步进行运动耗氧量(oxygen consumption,VO2)测试[12]。
对于可疑或确诊恶性病变的分期,目前正电子发射计算机断层显像(PET-CT)已成为排除肺外疾病、评估纵隔和肺门淋巴结,以及排除其他可疑肺结节的最佳影像学和代谢检查。超声支气管镜(endobronchial ultrasound,EBUS)和食管超声内镜(EUS)已成为用于纵隔分期的准确且侵入性较小的工具,可随后进行纵隔镜检查以排除影像学可疑淋巴结的假阴性结果[13]。脑部CT或磁共振成像(MRI)和腹部CT或超声检查,特别是在确诊腺癌的患者中,有助于完成NSCLC的术前分期。
手术技巧
准备
我们赞成硬膜外导管用于所有开胸手术患者的术后镇痛。也可以推荐留置胸膜下导管用于肋间神经阻滞。这种形式的非镇静镇痛对于降低术后呼吸系统并发症的风险非常重要,特别是对于计划进行局部切除的肺储备较差的患者。双腔气管插管或支气管堵塞器用于选择性单肺通气。当有疑问时,使用通过离体肺的开放腔引入儿科支气管镜透照要切除的肺段支气管,可能有助于识别正确的支气管解剖结构。
患者情况
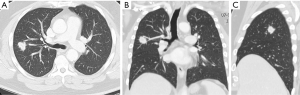
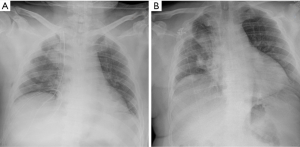
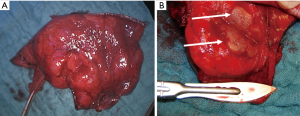
本文中描述的患者是一名 66 岁男性,最近因前列腺特异性抗原肿瘤标志物升高而被诊断为前列腺癌。在对他的前列腺癌进行进一步的肿瘤学筛查期间,腹部 CT 扫描在右肾中偶然发现了一个肿块。同时,胸部 CT 扫描显示右上叶后段(S3)有一个结节样肿物(图2),经 EBUS 引导下的穿刺活检证明是透明细胞癌的同步转移。腹腔镜右肾切除术治疗透明细胞癌(pT3N1M1)6周后,通过开胸进行解剖性右上叶后段切除术(S3)。病理检查提示转移灶(2.2×2×2 cm)来自透明细胞癌,切缘阴性,肺门和纵隔淋巴结阴性。患者恢复顺利,术后第 6 天出院回家,胸部X线片清晰(图3)。
展示
作者赞成前入路,因为这是目前我们所有开放式、VATS肺切除术以及双肺移植的标准入路。肺结构需要从前向后游离。一旦目标肺部分被移除,较大的气管和后纵隔就会暴露出来,以便额外的气道或动脉袖状切除术,以及纵隔淋巴结清扫。
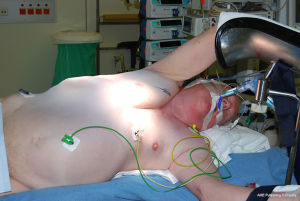
患者被置于半侧(45°)卧位。使用真空垫将身体固定在桌子上,同侧手臂支撑并保护在扶手上,对侧手臂放置在与身体成90°的扶手上(图4)。手术台在反Trendelenburg位置略微倾斜,双腿抬起以更好地静脉回流。在手术过程中,手术台可以随时根据需要转向外科医生或第一助手。将要切除的病灶的医学影像投影在大型计算机屏幕上以供术中会诊。在单肺通气或夹闭同侧主肺动脉期间,只要需要,患者的术中参数就会投影到视频屏幕上,以便外科医生进行心肺监测。
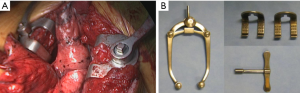
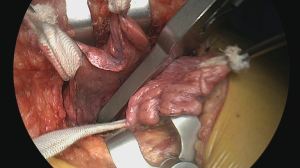
通过乳房下切口第四肋间进入胸部。由于胸大肌和前锯肌的前部是唯一需要分开的肌肉,因此该切口可进行保留肌肉的开胸手术。剩余的胸外肌肉可以用Richardson牵开器抬起,同时从前部(尽可能保留乳腺血管)一直向下切向后部的交感神经链水平。通过这样做,肋骨可以根据需要充分展开以用于肋间通路。我们更喜欢使用Price-Thomas肋骨牵开器,而不是经典的Finochietto牵开器,因为该器械在以V形打开胸部时能更好地稳定肋骨。可以根据皮下脂肪层和肌肉层的厚度调整牵开器的阀门,以避免使用其他软组织牵开器(图5)。有时,需要使用第二个Price-Thomas牵开器,通过将软骨与胸骨连接处脱位来更好地向前打开切口。
下一个也是最重要的步骤是在膈神经前方并穿过皮下皮肤层放置一条粗心包缝合线。通过系上这条缝线,受心包保护的心脏将被抬高,从而极大地暴露肺门血管,同时利于进入后纵隔。同时,心脏会保持在稳定位置,避免术中进一步牵引和压缩(图6)。
在胸部入口处,仔细检查胸膜腔和触诊肺部以排除其他意外病变。如果术前无组织诊断,且病灶位于外周且清晰,可先行楔形切除并术中冰冻切片检查。如果肺段内有更中央的病变,可以首先进行tru-cut针活检,或者在高度怀疑肿瘤的情况下,对适合的患者直接进行肺段切除术。如前所述,需要足够的肺门和段间淋巴结取样以及对切缘的评估,以确保从肿瘤学的角度正确行使手术。切除肺段后,可根据需要进行纵隔和肺门淋巴结清扫。
手术
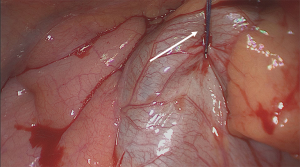
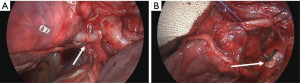
第一步是识别胸腔内解剖结构和肺门结构(图7)[14]。在我们的患者中,首先确定了上叶静脉。处理完肺门后,出现了三个主要的静脉分支。一根小分支从中叶排出静脉血;另外两个分支来自上叶(图8)。为了识别单个肺段解剖结构,在离断任何血管之前均需要打开裂间隙。首先,在裂间隙中识别出叶间肺动脉,并在前面建立一个与肺门区相连的通道。

然后使用线性切割器(图9)[15]分割水平裂。我们更喜欢使用ILATM 100可重复使用的吻合器(比利时美敦力,Jette),因为该设备是最便宜的吻合器,通常只需要一个钉子即可横断肺实质(图10)。有时,需要再借用ILATM 52上的钉子完成肺实质横断。理论上,对于上叶后段切除术,水平裂可以保持完整。然而,在肺实质分割后,三叶独自的静脉和动脉分支的叶间解剖结构变得更加清晰,避免了错误的横断。切开水平裂时注意不要损伤中叶动脉。下一步是将下叶背段和上叶基底部之间的斜裂向后分开。因此,从上叶支气管和中间支气管之间的叶间间隙向后方裂隙中的肺动脉形成了第二条通道。远离叶间动脉,手指从后面引导并立即用剪刀进行锐性分离有助于安全地创建这个通道。然后用相同的吻合器分割斜裂(通常使用ILATM 100上的一个钉子就足够了)。应小心注意不要损坏流向下叶背段(S6)的血管供应,因为该动脉分支可能会从相当高的叶间肺动脉中脱落。

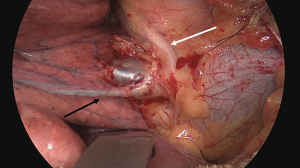
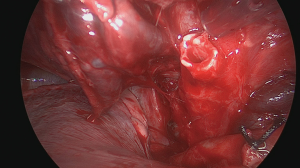
随着两个裂隙现在完全分开,肺段脉管系统的识别变得更加清晰(图11)。引流后段血液的静脉穿过裂隙中的动脉。应在引流中叶或上叶其他肺段的任何侧支静脉远端缝合或结扎将其分开。通常,到后段的肺段动脉(S3)从裂隙中的叶间动脉出发,也称为后升动脉(图12)。根据其大小,可以结扎、夹住或缝合该动脉(图13)[16]。在血管解剖不清晰、裂隙有炎症或疤痕组织时,用胶带环绕肺动脉进行近端把控可能很有用,但这不是我们的常规做法。分割脉管系统后,上叶支气管的分离变得清晰(图14)。然后可以通过更远端游离上叶支气管(图15)[17]来识别通向各个上叶肺段的三段支气管。用无损伤钳轻轻牵引要切除的肺段可能有助于暴露肺段支气管的分叉,因为这些分叉可能更深地隐藏在肺实质中。后段支气管(S3)通常在其肺段动脉的后面并行。

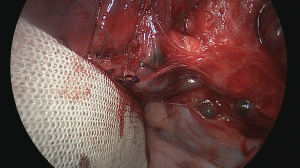

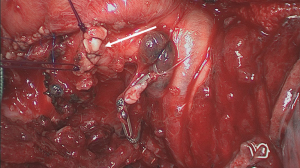
在横断气管之前,应在夹住肺段支气管的情况下对肺进行再通气,以验证解剖结构是否正确(图16)[18]。当不张的肺实质不再通气或通过侧支更缓慢地通过段间平面通气时,位于后段和其余两个节段(前段和尖段)之间的虚裂将变得更加清晰(图17)[19]。然后用吻合器或bistouri手术刀将段支气管分开(图18)。在远端支气管残端上轻轻牵引打开该段的肺门,从而更好地暴露被切除的实质。


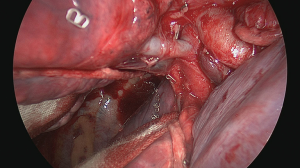
最后一步是横断段间平面,以从其余肺段(S1和S2)中甄别目标肺段(S3)(图19)[20]。这可以使用相同的线性吻合器或电烙术完成,同时肺的其余部分在夹住支气管残端的情况下进行通气。最后,如果没有使用吻合器闭合气道,则必须缝合支气管(图20)[21]。根据荷兰外科医生Klinkenberg先前描述的技术,在折叠支气管管腔内膜部分并将软骨环放在一起后,我们更喜欢使用两针4/0普迪思(PDS,polydioxanone)可吸收单丝重叠缝线手工缝合(图21)。


完成
然后在通气的情况下在水下测试余肺,以确定支气管或肺实质中是否有任何残余漏气。小支气管残端可以用支气管周围的任何脂肪或胸膜组织瓣覆盖,甚至可以用肺实质切割后剩余的吻合器线覆盖。为了避免肺门扭转,上叶的剩余肺段可以用血管钳给肺实质与中叶和/或下叶缝针,或拉拢和固定横断水平裂或斜裂后留下的两条吻合器线。
在仔细检查是否有出血后关胸。我们更喜欢放两根大小为CH 28的粗引流管;一个折曲在基底部隔膜上,另一个直达肺尖,头端在残腔里。肋骨可以用一根或两根(polyglyconate 2或polydioxanone 2)可吸收重肋骨线缝合。剩余的切口以正常的方式逐层闭合(图22)。然后将切除的标本送到病理科进行进一步的组织学和免疫学检查(图23)。
评论
术后护理
肺段切除术后的术后护理与其他接受肺切除术的患者相当。我们不会常规负吸引流管,除非由于大量漏气导致气胸或皮下气肿加重。术后护理的重点是充分镇痛和促进肺复张。一个专门的疼痛小组每天到病房查看我们的患者,检查患者自控的镇痛泵。专门的理疗、早期下床活动、定期床旁胸部X线片检查,以及低阈值的支气管镜检查和抗生素都有助于将肺部出现并发症的风险降至最低。
具体并发症
在大多数报道的系列中,肺段切除术后的并发症发生率和死亡率与肺叶切除术后的患者相当。与肺叶切除术相比,肺段切除术后残留空间问题较少见。然而,由于痰嵌塞或支气管解剖结构紊乱或持续漏气导致剩余肺段肺不张,特别是如果没有使用吻合装置来切割段间平面以试图保留残肺最大容积的情况下,术后恢复过程可能会变得复杂。由于局部血肿填充了切除肺段的剩余腔或邻近的肺实质,有时在胸部X线片上可以看到残留的假瘤。脓毒症患者剩余肺叶特有的渐进性肺叶浸润性病变可能是肺叶梗死的第一个迹象。在CT和支气管镜检查后,患者可能需要重新进行术中探查。
注意事项
空间法和游离单个支气管血管结构的顺序可能会根据要移除肺段而有所不同,但总体原则保持不变。最简单的术式是切除下叶背段(S6)、舌段(S4+S5)和下叶的基底段(S7-S10),而上叶的各个段(S1、S2、S3)和下叶(S7,S8,S9,S10)更具挑战性(图1)。
特定节段(S4-S5-S6)有一条独自的中央静脉,可以结扎或夹住,而其他肺段的静脉更靠近肺段的外围,直到段间平面开始解剖后才能识别,进入上静脉干或下静脉干的血流方向得以显现。有时,直到缝合肺实质后,这些静脉才会变得可识别。然而,重要的是在切割节段血管之前仔细识别静脉干的解剖结构,以避免无意中结扎从相邻节段引流血液的静脉。这可能会导致静脉血栓形成、大叶梗塞和术后潜在的灾难性并发症。
辨别合适的肺实质切割平面可能具有挑战性,尤其是在进行VATS肺段切除术时。通过在完全通气之前(或之后)夹住肺段支气管来对各个节段进行差异通气有助于更好地刻画段间平面。对于重度COPD患者,相邻肺段之间通过Kohn孔的侧支通气可能会影响段间平面的识别。
已经描述了两种用于游离肺实质的技术:开放法和切割吻合法。
在开放法中,在肺的其余部分通气良好的情况下,通过用夹子牵引横断的段支气管残端来撕裂段间平面。尖锐而钝的手指分离可能有助于打开段间平面。电凝、超声刀或钛夹用于确切止血,因为估计会有更多的失血。小的漏气可以用细缝线缝合。此外,从脏层胸膜剥除的相邻肺段的粗面可以用胸膜或心包脂肪瓣覆盖,以进行加固和止血。必须小心避免由皮瓣引起的残余支气管血管结构的压缩或扭结。这可能最终导致肺叶失功,从而消除了肺段切除术对比肺叶切除术的优势。非缝合技术的优点是相邻实质的再扩张最大程度地填充了空的肺段空间,但它具有更高的风险,即未缝合或夹闭的不明细支气管长期漏气,导致细支气管胸膜瘘。
在闭合法中,虚裂在线性吻合器的帮助下被压缩和切割。我们更喜欢装订长度为10.0 cm的可重复使用的线性切割设备。通常需要1个以上的钉子。这种技术可以更好地控制剩余肺的气压,但其代价是容积损失,因为打钉子时脏层胸膜被缝合在一起。然后,剩余的薄壁组织在某种程度上被单个吻合钉困住,阻止肺叶重新扩张直到其最大体积。
总结
近80年来,肺段切除术一直是胸外科医生的医疗措施的一部分。在过去的40年里,肺段切除术的适应证已经从感染后切除破坏的肺段的程序,转变为非常早期的外周型(IA期≤2.0 cm)NSCLC患者,或心肺储备有限、大小和位置良好,且无淋巴结受累的NSCLC患者的手术选择。回顾性和单中心的研究表明,在精心挑选的小(≤2.0 cm)周围型肿瘤(主要是腺癌)患者中,解剖性肺段切除术的结果非常好,与肺叶切除术相当。然而,在肺段切除术成为早期NSCLC的标准切除手术之前,我们需要等待两项正在进行的随机对照试验的结果。VATS或RATS方法用于亚肺叶切除术已被证明是可行的,可实现与肺段切除开放手术相当的、出色的生存结果,但住院时间更短,肺部并发症发病率更低。这种方法的支持者认为它很可能成为肺癌手术的未来[22]。
Acknowledgements
None.
Footnote
Conflicts of Interest: The authors have no conflicts of interest to declare.
References
- Churchill ED, Belsey R. Segmental pneumonectomy in bronchiectasis: the lingula segment of the left upper lobe. Ann Surg 1939;109:481-99. [Crossref] [PubMed]
- Jensik RJ, Faber LP, Milloy FJ, et al. Segmental resection for lung cancer. A fifteen-year experience. J Thorac Cardiovasc Surg 1973;66:563-72. [PubMed]
- Hennon M, Landreneau RJ. Role of Segmentectomy in Treatment of Early-Stage Non-Small Cell Lung Cancer. Ann Surg Oncol 2017. [Epub ahead of print]. [Crossref] [PubMed]
- Sesti J, Donington JS. Sublobar Resection: Ongoing Controversy for Treatment for Stage I Non-Small Cell Lung Cancer. Thorac Surg Clin 2016;26:251-9. [Crossref] [PubMed]
- Landreneau RJ, D’Amico TA, Schuchert MJ, et al. Segmentectomy and Lung Cancer: Why, When, How, and How Good? Semin Thorac Cardiovasc Surg 2017;29:119-28. [Crossref] [PubMed]
- Comparison of Different Types of Surgery in Treating Patients With Stage IA Non-Small Cell Lung Cancer. Available online: https://clinicaltrials.gov/ct2/show/record/NCT00499330
- Nakamura K, Saji H, Nakajima R, et al. A phase III randomized trial of lobectomy versus limited resection for small-sized peripheral non-small cell lung cancer (JCOG0802/WJOG4607L). Jpn J Clin Oncol 2010;40:271-4. [Crossref] [PubMed]
- Yang CF, D’Amico TA. Open, thoracoscopic and robotic segmentectomy for lung cancer. Ann Cardiothorac Surg 2014;3:142-52. [PubMed]
- Atkins BZ, Harpole DH Jr, Mangum JH, et al. Pulmonary segmentectomy by thoracotomy or thoracoscopy: reduced hospital length of stay with a minimally-invasive approach. Ann Thorac Surg 2007;84:1107-12; discussion 1112-3. [Crossref] [PubMed]
- Schuchert MJ, Pettiford BL, Pennathur A, et al. Anatomic segmentectomy for stage I non-small-cell lung cancer: comparison of video-assisted thoracic surgery versus open approach. J Thorac Cardiovasc Surg 2009;138:1318-25.e1. [Crossref] [PubMed]
- Ghaly G, Kamel M, Nasar A, et al. Video-Assisted Thoracoscopic Surgery Is a Safe and Effective Alternative to Thoracotomy for Anatomical Segmentectomy in Patients With Clinical Stage I Non-Small Cell Lung Cancer. Ann Thorac Surg 2016;101:465-72; discussion 472. [Crossref] [PubMed]
- Brunelli A, Charloux A, Bolliger CT, et al. ERS/ESTS clinical guidelines on fitness for radical therapy in lung cancer patients (surgery and chemoradiotherapy). Eur Respir J 2009;34:17-41. [Crossref] [PubMed]
- De Leyn P, Dooms C, Kuzdzal J, et al. Revised ESTS guidelines for preoperative mediastinal lymph node staging for non-small-cell lung cancer. Eur J Cardiothorac Surg 2014;45:787-98. [Crossref] [PubMed]
- Frick AE, Van Raemdonck D. The hilar anatomy after opening the chest. Asvide 2017;4:355. Available online: http://www.asvide.com/articles/1669
- Frick AE, Van Raemdonck D. The division of the horizontal fissure between the upper lobe and the middle lobe anteriorly. Asvide 2017;4:356. Available online: http://www.asvide.com/articles/1670
- Frick AE, Van Raemdonck D. The posterior ascending artery and vein (S3) ligated and divided. Asvide 2017;4:357. Available online: http://www.asvide.com/articles/1671
- Frick AE, Van Raemdonck D. The bronchial anatomy after complete division of the oblique fissure between upper and lower lobe. Asvide 2017;4:358. Available online: http://www.asvide.com/articles/1672
- Frick AE, Van Raemdonck D. Clamping of the posterior segmental bronchus (S3) prior to reventilation. Asvide 2017;4:359. Available online: http://www.asvide.com/articles/1673
- Frick AE, Van Raemdonck D. Reventilation of the remaining upper lobe after clamping the posterior segmental bronchus. Asvide 2017;4:360. Available online: http://www.asvide.com/articles/1674
- Frick AE, Van Raemdonck D. The virtual fissure between the anterior and posterior segment is transected using a re-usable linear stapler. Asvide 2017;4:361. Available online: http://www.asvide.com/articles/1675
- Frick AE, Van Raemdonck D. This posterior segmental bronchus prior to suturing. Asvide 2017;4:362. Available online: http://www.asvide.com/articles/1676
- Swanson SJ. Video-assisted thoracic surgery segmentectomy: the future of surgery for lung cancer? Ann Thorac Surg 2010;89:S2096-7. [Crossref] [PubMed]

宁君伟
上海市胸科医院肿瘤外科住院医师。硕士,擅长肺部肿瘤、纵隔肿瘤等胸外科常见疾病的诊治,辅助双/多孔胸腔镜以及单孔3D胸腔镜手术,从事早期及局部晚期肺癌相关临床研究。以共一作者于Annals of Thoracic Surgery发表论著1篇,以共同作者发表SCI论著3篇,参与两项国家自然科学基金课题。(更新时间:2021/8/6)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Frick AE, Van Raemdonck D. Segmentectomies. Shanghai Chest 2017;1:28.